CORRIGE de Chimie
Liban - Section S - Juin 2007
De la reine des prés à l'aspirine
I] Etude de l’acide
salicylique :
1) Un acide au sens de
Brönsted est une espèce chimique capable de céder un
proton 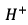 .
.
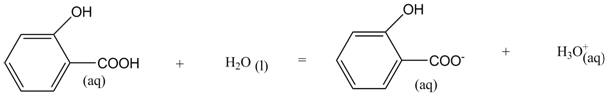
2) Equation chimique de la
réaction de l’acide salicylique avec l’eau :
3) Tableau d’avancement :
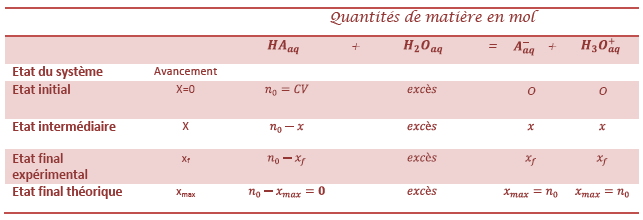
4) Le taux
d’avancement est défini par :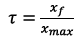
![]() Calculons
Calculons
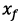 :
:
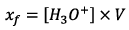 (D’après le tableau d’avancement)
(D’après le tableau d’avancement)
Or, 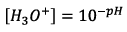
D’où,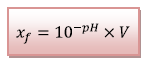
![]() Calculons
Calculons
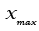 :
:
Si la réaction est totale
alors 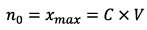
![]() Calculons
le taux d’avancement :
Calculons
le taux d’avancement :
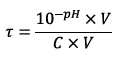
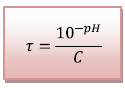
Application numérique :
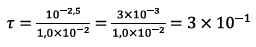
Soit,
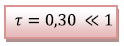 donc cette réaction n’est donc pas totale mais
limitée.
donc cette réaction n’est donc pas totale mais
limitée.
5) Le quotient de réaction à
l’équilibre est défini par :
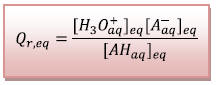
D’après le tableau
d’avancement on a : 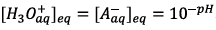 .
.
D’après la conservation de
la matière on a : 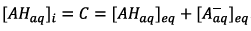 .
.
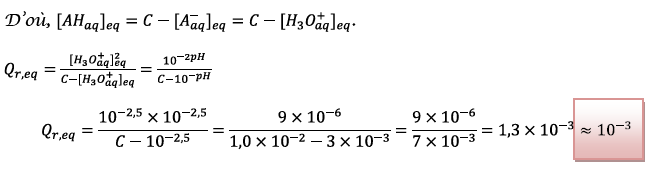
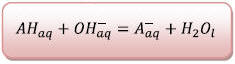
7.2) Méthode des
tangentes :
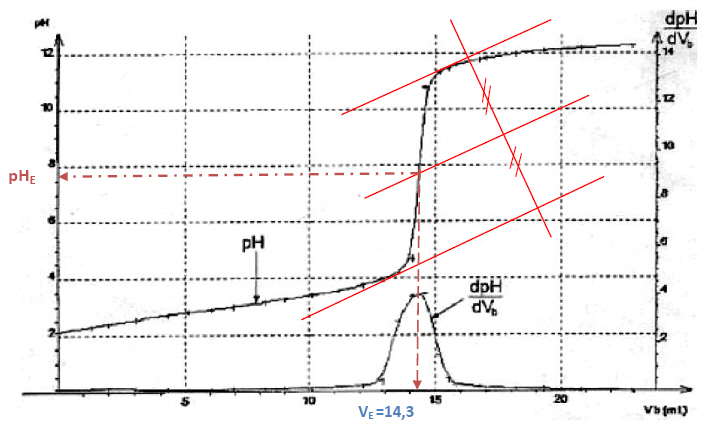
On lit sur le graphe
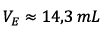 .
.
La dérivée
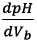 admet
un maximum à l’équivalence, on lit en abscisse
admet
un maximum à l’équivalence, on lit en abscisse
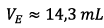
7.3)
L’équivalence du titrage
correspond au moment où les réactifs du dosage sont
introduits dans les proportions stœchiométriques
(on introduit juste assez de réactif titrant pour
consommer toutes les molécules du réactif titré) :
les deux réactifs sont totalement consommés. Le
réactif titré devient le réactif limitant.
A l’équivalence les réactifs sont introduits dans
les proportions stœchiométriques on a donc :
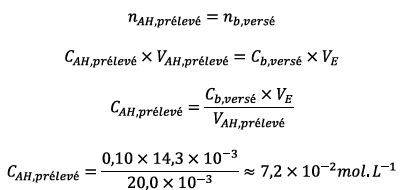
La concentration molaire de l’acide salicylique de
la solution diluée est :
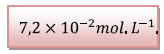
On a diluée 10 fois la
solution pharmaceutique donc la concentration en
acide salicylique de la solution pharmaceutique est
10 fois supérieure à celle diluée :
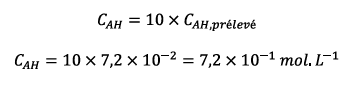
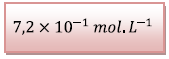
7.4) Pour choisir un bon
indicateur coloré il faut que sa zone de virage
comprenne le pH équivalent.
Pour ce dosage à l’équivalence pHE
= 7,8 donc il faut choisir le rouge de crésol
comme indicateur coloré afin de visualiser le
changement de couleur au moment de l’équivalence.
II] De l’acide
salicylique à l’aspirine :
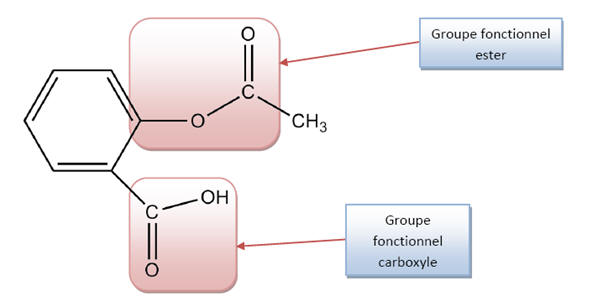
1) La molécule
d’aspirine :
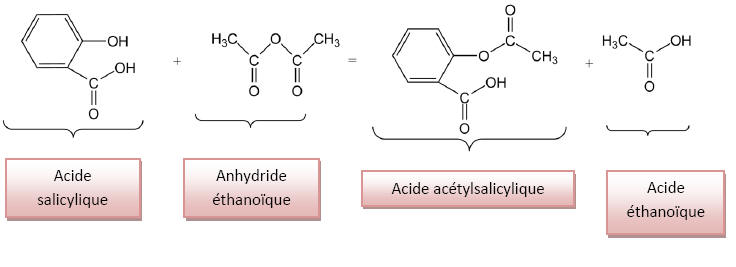
2) Equation chimique de la
réaction de synthèse de l’acide acétylsalicylique :
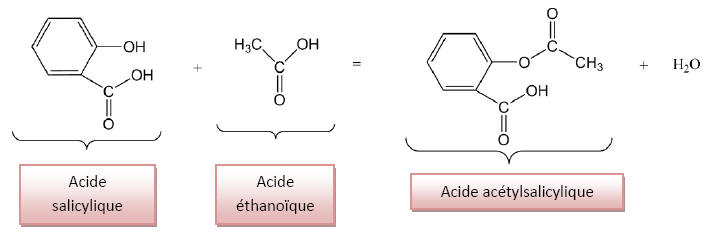
Il s’agit d’une réaction
d’estérification. Elle est lente, limitée.
3.1) Les ions oxonium
jouent le rôle de catalyseur pour la
réaction.
Un catalyseur est une espèce chimique qui permet
d’augmenter la vitesse de réaction chimique
spontanée sans en modifier l’état final.
Ainsi, l’équilibre est atteint plus rapidement sans
être modifié.
Le catalyseur n’apparaît pas dans le bilan global de
la réaction.
3.2) Le fait d’introduire
un réactif en excès permet d’augmenter le rendement
de la synthèse. En effet l’équilibre est déplacé
dans le sens d’évolution de la réaction (sens
direct). Il en résulte une augmentation de la
quantité de produit formé et par conséquent un
augmentation du rendement.
De plus, cela permet d’augmenter la vitesse de
réaction car la concentration est un facteur
cinétique.
4) L’acide éthanoïque peut
être remplacé par l’anhydride éthanoïque
(famille : anhydride d’acide). La réaction
d’estérification devient alors totale et rapide.