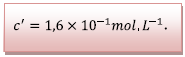CORRIGE de Chimie
Asie - Section S - Juin 2006
Evolution d'un système chimique
I] Etude de solutions
aqueuses d’acide méthanoïque et d’acide benzoïque de
même concentration.
1.1.1) Réaction de l’acide méthanoïque avec l’eau :
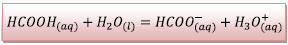
1.1.2) Tableau d’avancement :
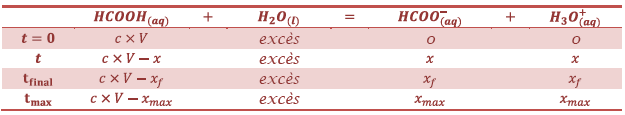
![]() Détermination de l’avancement final :
Détermination de l’avancement final :
D’après le tableau
d’avancement on a :
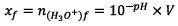
Or,
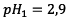
D’où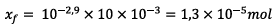
L’avancement maximal de la
réaction est 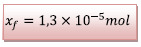
![]() Détermination de l’avancement maximal :
Détermination de l’avancement maximal :
D’après le tableau
d’avancement on a :
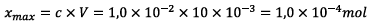
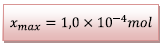
![]() Taux d’avancement :
Taux d’avancement :
Par définition : 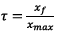
Donc 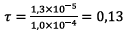
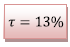
1.1.3) On déduit
du calcul du taux d’avancement que la réaction
mettant en jeu l’acide méthanoïque et l’eau n’est
pas totale mais limitée car 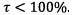
1.2)
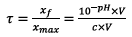
D’où 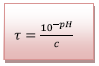
Les deux solutions ont la
même concentration donc seul le
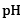 agit sur le taux d’avancement. Ainsi, plus le pH est
faible et plus le taux d’avancement est élevé. Or,
agit sur le taux d’avancement. Ainsi, plus le pH est
faible et plus le taux d’avancement est élevé. Or, 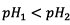 donc la réaction
avec l’eau est plus avancée pour l’acide
méthanoïque.
donc la réaction
avec l’eau est plus avancée pour l’acide
méthanoïque.
II] Evolution d’un
système chimique
2.1) 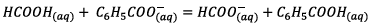
![]() La constante d’équilibre associée à cette
réaction est :
La constante d’équilibre associée à cette
réaction est :
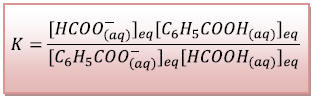
Calculons cette constante
d’équilibre en fonction de
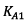 et
et
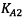 :
:
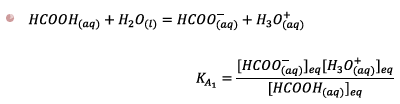
La concentration en 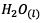 n’intervient
pas dans l’expression de la constante d’équilibre
car c’est le solvant.
n’intervient
pas dans l’expression de la constante d’équilibre
car c’est le solvant.
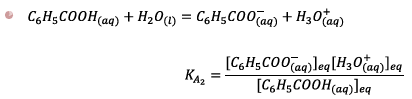
Or,
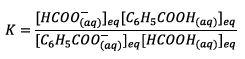
Si on multiplie le
numérateur et le dénominateur par 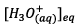 on
exprime la constante d’équilibre K en fonction des
constantes d’équilibre
on
exprime la constante d’équilibre K en fonction des
constantes d’équilibre 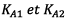 :
:
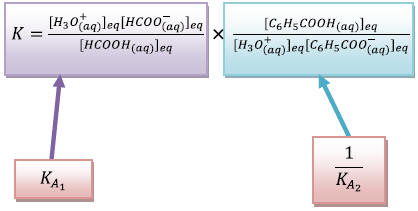
D’où
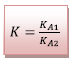
Calcul de la constante
d’équilibre  :
:
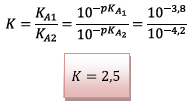
2.2.1) quotient de
réaction à l’état initial :
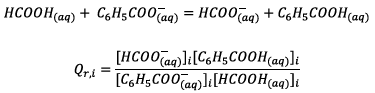
Donc
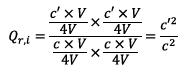
D'où
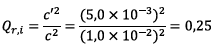
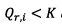 donc
le système chimique va évoluer dans le sens
direct.
donc
le système chimique va évoluer dans le sens
direct.
2.2.2) Le système est en
équilibre si 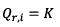
Donc si :
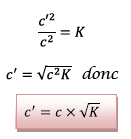
D'où
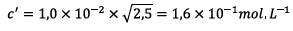
Pour que le système chimique soit en équilibre il faut
que :