CORRIGE de Chimie
Nouvelle Calédonie - Section S - Novembre 2004
Etat final d'un système chimique :
étude par spectrophotométrie et titrage
I] Suivi spectrophotométrique de la
transformation chimique
1.1) On peut effectuer un suivi cinétique avec la
mesure de la conductivité 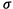 qui
est une méthode qui n’affecte pas le milieu
réactionnel c’est-à-dire non destructive.
qui
est une méthode qui n’affecte pas le milieu
réactionnel c’est-à-dire non destructive.
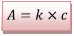
D’où
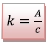
Avec le couple de valeurs
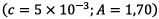 on a :
on a :
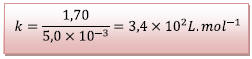
1.2.2) La seule espèce colorée du mélange est le
diiode et l’absorbance du mélange est
proportionnelle à la concentration c du diiode
donc :
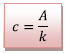
Or
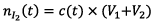
Donc
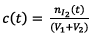
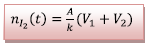
1.2.3) A t=90 min on a A=0,79
Donc
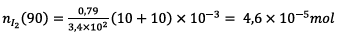
La quantité de diiode formé à t=90 min est de
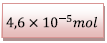
1.3.1)
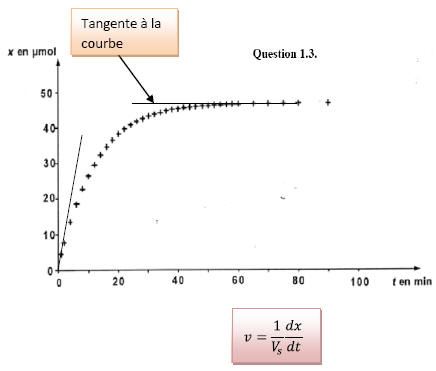
D’après la définition de la vitesse de réaction v,
on sait que v est proportionnelle à
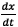 qui
est le coefficient directeur de la tangente à la
courbe. On remarque que la pente de la tangente à la
courbe diminue donc la vitesse de réaction diminue
également et à t≈70 min la courbe admet une tangente
horizontale donc la vitesse de réaction est nulle.
qui
est le coefficient directeur de la tangente à la
courbe. On remarque que la pente de la tangente à la
courbe diminue donc la vitesse de réaction diminue
également et à t≈70 min la courbe admet une tangente
horizontale donc la vitesse de réaction est nulle.
1.3.2) Au cours de la réaction, les réactifs sont
consommés donc la concentration des réactifs diminue
ce qui entraîne la diminution de la vitesse de
réaction. La vitesse de réaction devient nulle
lorsque le réactif limitant est totalement consommée
(fin de réaction) ou lorsque la réaction atteint un
état d’équilibre.
1.3.3)
On pourrait atteindre plus rapidement l’état final à
partir du même mélange initial S en agissant sur la
température qui est un facteur cinétique.
II] Titrage du diiode formé après 90 minutes de
réaction.
2.1)
2.2) L’équivalence du titrage
correspond au moment où les réactifs du dosage sont
introduits dans les proportions stœchiométriques
(on introduit juste assez de réactif titrant pour
consommer toutes les molécules de réactifs titré) :
les deux réactifs sont totalement consommés. Le
réactif titré devient le réactif limitant.
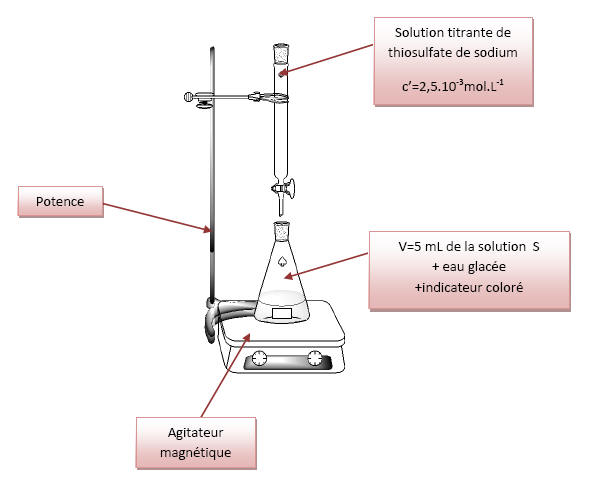
2.3.1) A l’équivalence les réactifs sont introduits
dans les proportions stœchiométriques on a donc :
Pour effectuer le dosage on a prélevé 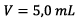 du
mélange initial S et
du
mélange initial S et 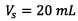 donc
donc
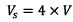 .
.
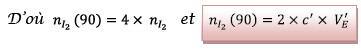
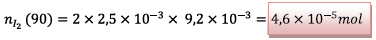
Cette valeur est compatible avec la valeur trouvée à
la question 1.2.3.
III] Etude théorique et bilan comparatif
3.1) Les couples mis en jeu lors de la réaction
sont :
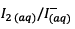 et
et
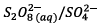
Les demi-équations redox associées sont :
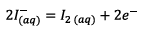 (Oxydation des ions iodure).
(Oxydation des ions iodure).
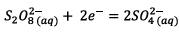 (Réduction
des ions peroxodisulfate).
(Réduction
des ions peroxodisulfate).
Donc l’équation de la réaction associée est :
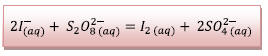
3.2) Tableau d’avancement :

3.2.3) La réaction est supposée totale.
Détermination
de l’avancement maximal
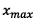 :
:
![]() Si
Si
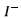 est
le réactif limitant alors on a :
est
le réactif limitant alors on a :
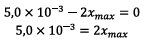
D’où
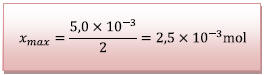
![]() Si
Si
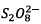 est
le réactif limitant alors on a :
est
le réactif limitant alors on a : 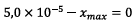
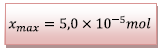
Conclusion : le
réactif limitant est 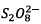 car il conduit à
l’avancement maximal le plus faible donc :
car il conduit à
l’avancement maximal le plus faible donc :
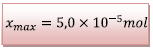
D’après le tableau d’avancement la quantité maximale de diiode formée est :
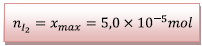
3.3.1) Les valeurs
expérimentales calculées aux questions 1.2.3 et
2.3.2 conduisent à la même quantité de diiode formé
soit :
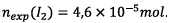
La valeur théorique conduit quand à elle à :
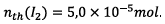
![]() L’écart
relatif entre la valeur expérimentale et la valeur
théorique est :
L’écart
relatif entre la valeur expérimentale et la valeur
théorique est :
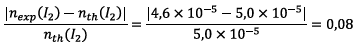
Soit un écart relatif de

3.3.2) La quantité de
diiode formé au cours des expériences est inférieure
à la quantité théoriquement attendue. Cela peut être
du soit aux erreurs liées aux manipulations telle
que la lecture du volume équivalent, soit au fait
que lors de la détermination de la quantité
expérimentale de diiode formé la réaction n’avait
pas encore atteint son état final.