CORRIGE de Chimie
France Métropolitaine - Section S - Juin 2004
A propos de l'aspirine
I] Etude de la
transformation chimique par une mesure de pH
1. On donne la mesure du
pH de la solution S à l’équilibre : pH=2,9
Par définition : pH= - log
[H3O+] eq
Donc 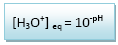
A l’équilibre la
concentration en ions oxonium dans la solution S
préparée est :
[H3O+]
eq = 10-2,9
Soit [H3O+]
eq = 1,3. 10-3 mol.L-1
2. Réaction entre l’acide
acétylsalicylique AH et l’eau :
AH
s + H20l = A-aq
+ H3O+aq
3.
Tableau d’avancement:
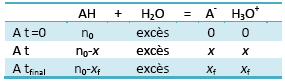
Avec n0 = Vs.
Cs
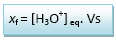
D’après les données de
l’énoncé Vs=500mL soit Vs= 500.10-3L
D’après la question 1 [H3O+]
eq = 10-2,9 = 1,3.10-3
mol.L-1
Application numérique :
xf
=10-2,9 *500.10-3=
6,3.10-4 mol
4. Par définition xmax
correspond à l’avancement de la réaction si
elle est totale c’est-à-dire si le réactif limitant
est totalement consommé.
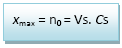
(Car l’eau est en excès
donc le réactif limitant de cette réaction est
l’acide acétylsalicylique).
A.N : xmax
= n0 = Vs. Cs = 5,55. 10-3*
500.10-3 = 2,8.10-3 mol
5. Par définition le taux
d’avancement final d’une réaction est le rapport de
l’avancement final (xf) sur
l’avancement maximal (xmax)
ainsi :

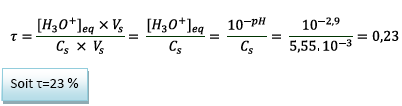
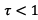 donc la
réaction étudiée n’est pas totale.
donc la
réaction étudiée n’est pas totale.
II] Détermination de la
constante d’équilibre de la réaction par
conductimétrie
A 25°C, la conductivité de la solution S vaut σ=
44 mS.m-1.
D’après l’énoncé 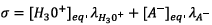 (relation
1)
(relation
1)
1. 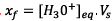 et
d’après le tableau d’avancement
et
d’après le tableau d’avancement 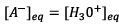
Donc en reportant dans la relation 1 :
![]()
D’où ![]()
Donc
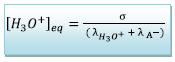
Or 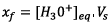
On déduit
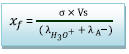
2. Application numérique :
Attention à la conversion 1m3= 1000L
Donc
500 mL= 500.10-6
m3
![]()
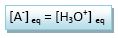
D’après le tableau
d’avancement
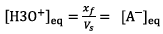
Or
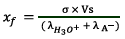
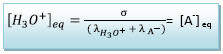
D’où [H3O+] eq = [A-] eq = 1,17 mol.m-3
Soit [H3O+] eq = [A-] eq = 1,17.10-3 mol.L-1
D’après le tableau d’avancement,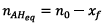
Donc
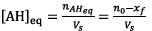
Or
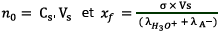
Donc
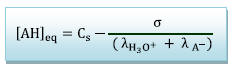
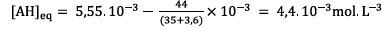 Attention à la conversion
Attention à la conversion
4. Constante d’équilibre
AH + H2O = A-
+ H3O+
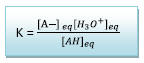
Application numérique:
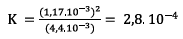
III] Précision des deux
techniques utilisées : par pH-métrie et
conductimétrie
Par la méthode pH-métrique
on a xf
![]() [5,0.10-4 ;
7,9.10-4] mol, l’écart entre les deux
valeurs de
[5,0.10-4 ;
7,9.10-4] mol, l’écart entre les deux
valeurs de
![]() est
de 2,9.10-4 mol.
est
de 2,9.10-4 mol.
Par la méthode
conductimétrique on a xf
![]() [5,6.10-4 ;
5,8.10-4] mol, l’écart entre les deux
valeurs de
[5,6.10-4 ;
5,8.10-4] mol, l’écart entre les deux
valeurs de
![]() est
de 2.10-5 mol.
est
de 2.10-5 mol.
La technique
conductimétrique est donc plus précise que la
méthode pH-métrique.