CORRIGE de Chimie
Polynésie - Section S - Septembre 2003
Autour d'une transformation
dans le domaine de l'oxydoréduction
I] Etude d’une réaction
d’oxydoréduction lorsque les deux réactifs sont
directement en contact.
1)
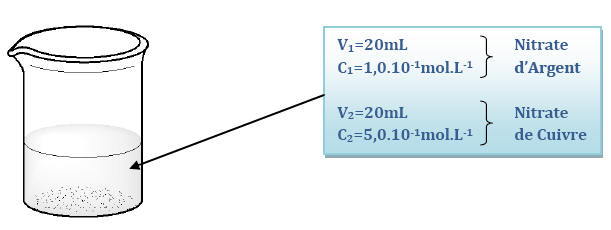
Dans le bécher le nitrate d’argent et le nitrate de cuivre sont totalement ionisés :
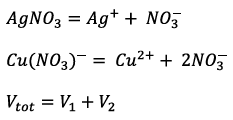
![]() Concentration initiale en
Concentration initiale en
![]()
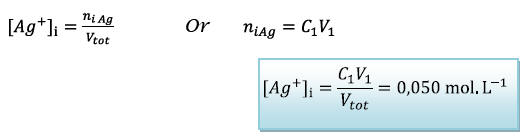
![]() Concentration initiale en
Concentration initiale en
![]()

2) a) Quotient de réaction
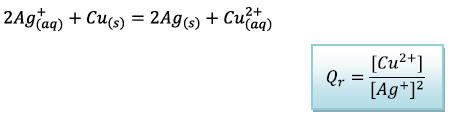
b) Quotient de réaction à
l’état initiale
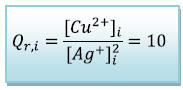
c) 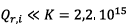 donc
le système évolue spontanément dans le sens direct.
donc
le système évolue spontanément dans le sens direct.
d) La solution devrait se
colorer en bleu, couleur due à la présence des ions 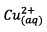 dont
la concentration augmente au fur et à mesure de la
réaction.
dont
la concentration augmente au fur et à mesure de la
réaction.
e) On détermine le
quotient de réaction à l’équilibre noté 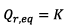
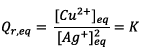
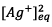
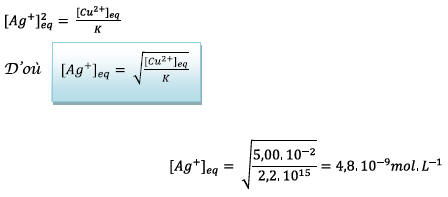
On peut donc considérer
que les ions 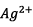 sont
à l’état de trace.
sont
à l’état de trace.
La réaction peut donc considérer que le réactif
limitant l’argent est totalement consommé, la
réaction peut être considérée totale.
II] Constitution et
étude d’une pile
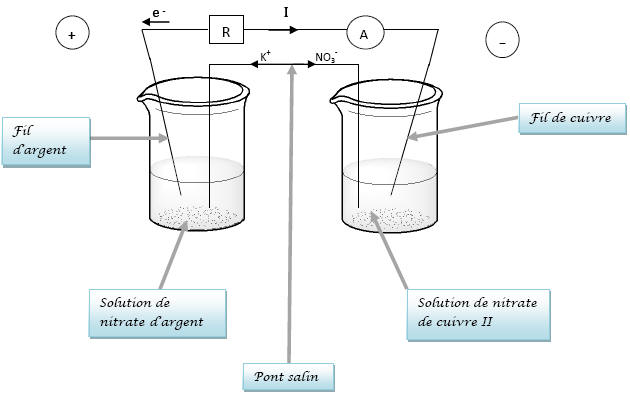
2) a) Les
électrons circulent dans le sens opposé à celui du
courant. Donc, si le courant circule de l’argent
vers le cuivre alors les électrons se déplacent de
l’électrode de cuivre à l’électrode d’argent.
b)
Réaction :
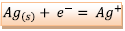 ,
il se produit une réduction (gain d’électrons)
donc l’électrode d’argent est la cathode, pôle
positif.
,
il se produit une réduction (gain d’électrons)
donc l’électrode d’argent est la cathode, pôle
positif. Réaction :
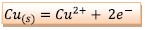 ,
il se produit une oxydation (perte d’électrons)
donc l’électrode de cuivre est l’anode, pôle
négatif.
,
il se produit une oxydation (perte d’électrons)
donc l’électrode de cuivre est l’anode, pôle
négatif.c) L’équation de la
réaction spontanée est donc :
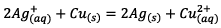
Le sens de la réaction
spontanée est en accord avec la question I-2-a.
d) Le pont salin permet
d’assurer la neutralité des solutions et de fermer
le circuit pour permettre le passage du courant
entre les deux solutions. Le pont salin comble le
déficit en charge de chaque solution, les ions 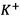 compensent la
disparition des ions
compensent la
disparition des ions 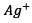 et les ions
et les ions 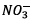 permettent de
neutraliser les ions
permettent de
neutraliser les ions 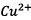 formés.
formés.
3) a)
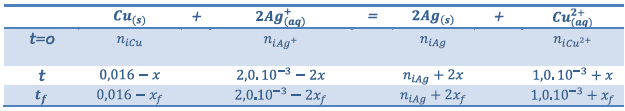
Calculs des quantités de
matière des conditions initiales :
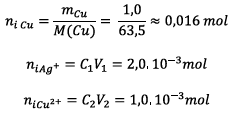
b)
- Si
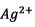 est le réactif limitant alors
est le réactif limitant alors
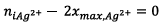
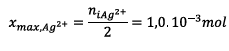
- Si Cu est le réactif limitant alors
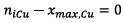
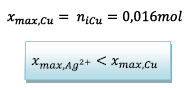
Donc ce sont les ions argent qui
forment le réactif limitant et

c)
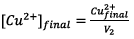 d’après
le tableau
d’après
le tableau
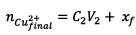
D’où
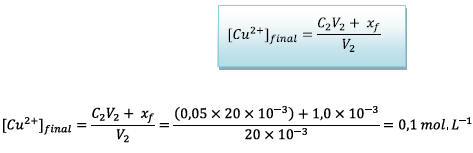
d)
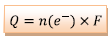
D’après La demi-équation qui à lieu à l’électrode de cuivre :
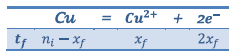
Donc
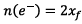 (2 électrons sont transférés à chaque fois)
(2 électrons sont transférés à chaque fois)
D’où
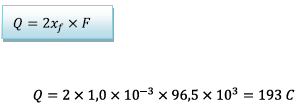
La quantité d’électricité
qui a traversée la résistance depuis l’instant où la
pile a commencé à débiter jusqu’à l’instant où la
pile s’arrête est![]()
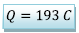
e) D’après l’énoncé « la
capacité notée 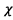 d’une pile est la
quantité maximale d’électricité qu’elle peut fournir
avant d’être usée. »
d’une pile est la
quantité maximale d’électricité qu’elle peut fournir
avant d’être usée. »
Donc on a 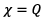 sachant
que
sachant
que 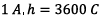 on
a
on
a 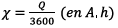
D’où
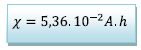
*En
effet
![]() Coulomb avec I en Ampère et t en seconde. Or une
heure vaut 3600s. Donc 1 A.h vaut
Coulomb avec I en Ampère et t en seconde. Or une
heure vaut 3600s. Donc 1 A.h vaut
![]()
26/02/2007