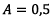CORRIGE de Chimie (Enseignement de spécialité)
Nouvelle Calédonie - Section S - Juin 2003
Dosage de la caféine
I]
Extraction de la
caféine
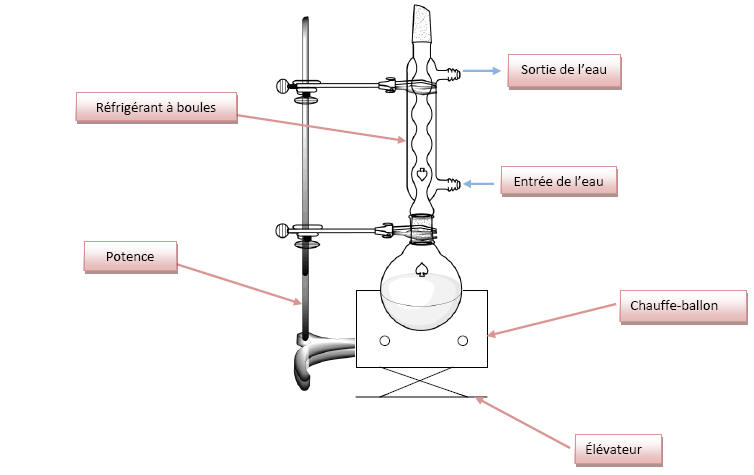
1.1) le réfrigérant permet
la condensation des vapeurs d’eau issues du milieu
réactionnel, qui retombent dans le ballon sous forme
de gouttelettes. Ce qui empêche la perte de matière.
Montage du chauffage à reflux :
1.2) D’après l’énoncé, la
caféine est très peu soluble dans l’eau à 25°C en
revanche la solubilité de la caféine est très
importante dans l’eau à 65°C c’est pourquoi le fait
de chauffer le mélange
1.3) La phase organique
est recueillie grâce à une ampoule à décanter :
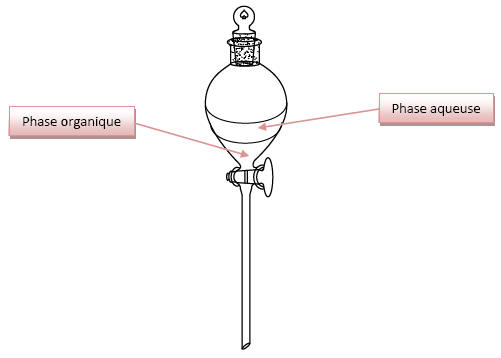
La phase aqueuse a une
densité de 1, tandis que la phase organique possède
une densité de l’ordre de 1,30 car elle est
constituée du dichlorométhane dont la densité est
1,30. Les deux phases étant non miscibles la phase
possédant la densité la plus grande se situe dessous
(voir le schéma).
La phase aqueuse est
refroidie donc la caféine redevient très peu soluble
dans l’eau à 25°C. Cependant, la caféine est très
soluble dans le dichlorométhane donc la majeure
partie de la caféine se trouve dans la phase
organique (dichlorométhane).
1.4) La technique mis en
œuvre dans l’étape 2 est la décantation (ou
extraction liquide-liquide) qui permet de séparer
deux liquide non miscibles.
1.5) Le sulfate de
magnésium anhydre permet de déshydrater la phase
organique en éliminant les traces d’eau encore
présentes dans la phase organique.
1.6) On peut purifier la
caféine extraite par recristallisation.
La technique consiste à dissoudre dans un
premier temps le solide impur dans un solvant
(adapté où les impuretés sont solubles) à chaud ce
qui permet de libérer les impuretés. Puis on laisse
lentement refroidir. On peut éventuellement
favoriser la recristallisation par un bain d’eau
glacée. Une fois le solide recristallisé les
impuretés restent en solution, il suffit donc de
filtrer la solution sur filtre Büchner par exemple
pour récupérer le solide pur.
II] Préparation de
solutions de caféine de différentes concentrations.
On réalise une dilution :
Il y a conservation de matière entre la solution
mère et la solution fille donc :
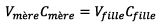
Pour préparer une solution
fille de concentration 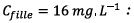
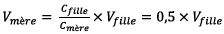
Protocole expérimental
pour préparer une solution fille de 10 mL et de
concentration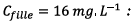
On verse dans un bécher de
100 mL environ 20 mL de la solution mère, puis à
l’aide d’une pipette jaugée de 5 mL surmontée d’une
propipette on prélève de la solution mère dans le
bécher que l’on verse dans une fiole jaugée de 10 mL.
Puis on complète la solution jusqu’au trait de jauge
avec de l’eau distillée tout en homogénéisant la
solution (en agitant la fiole).
III] Mesure
d’absorbance.
3.1) Les longueurs d’onde sont comprise entre 220 nm
et 320 nm donc elles appartiennent au domaine de
l’ultraviolet car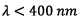 .
.
3.2) D’après la droite d’étalonnage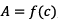
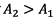
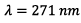 est
est